PRIME CAR-T
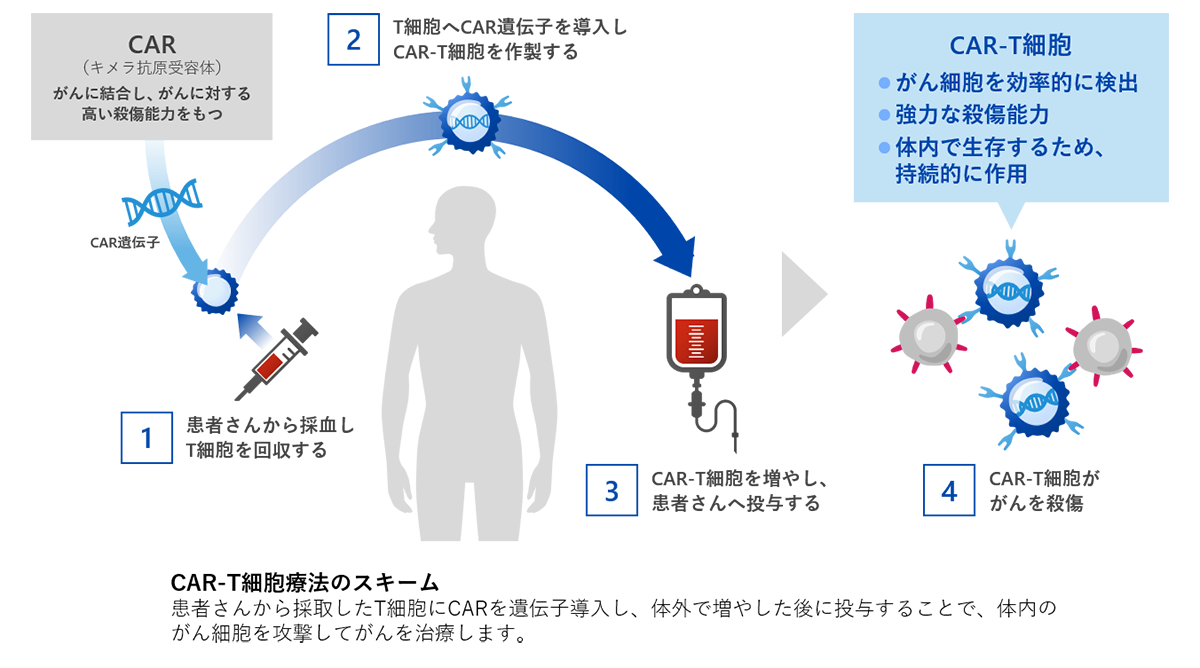
CAR-T細胞療法
CAR-T細胞は、患者さんの血液から採取したT細胞と呼ばれる白血球の一種に、がん細胞を高感度に見つけ出し、かつ強力に攻撃する能力を持つキメラ抗原受容体(Chimeric Antigen Receptor : CAR)と呼ばれる人工的な遺伝子を導入して製造します。これを1~2週間程度体外で増やした後に患者さんに投与して治療するのがCAR-T細胞療法です。CAR遺伝子を導入されたCAR-T細胞は、がん細胞の目印となるがん抗原を認識し、これを標的として攻撃します。
CAR-T細胞療法の開発経緯と現状
CAR-T細胞療法はこれまでに血液がんに対する治療法として開発が進められ、特にB細胞性の白血病やリンパ腫に高発現しているCD19抗原や、骨髄腫に高発現しているBCMA抗原を標的とした治療で良好な臨床試験の結果を示しました。その結果、最初のCD19 CAR-T細胞療法は血液がんを対象として2017年には米国FDA、2018年には欧州EMAで承認され、日本国内においても2019年3月に薬事承認されました。
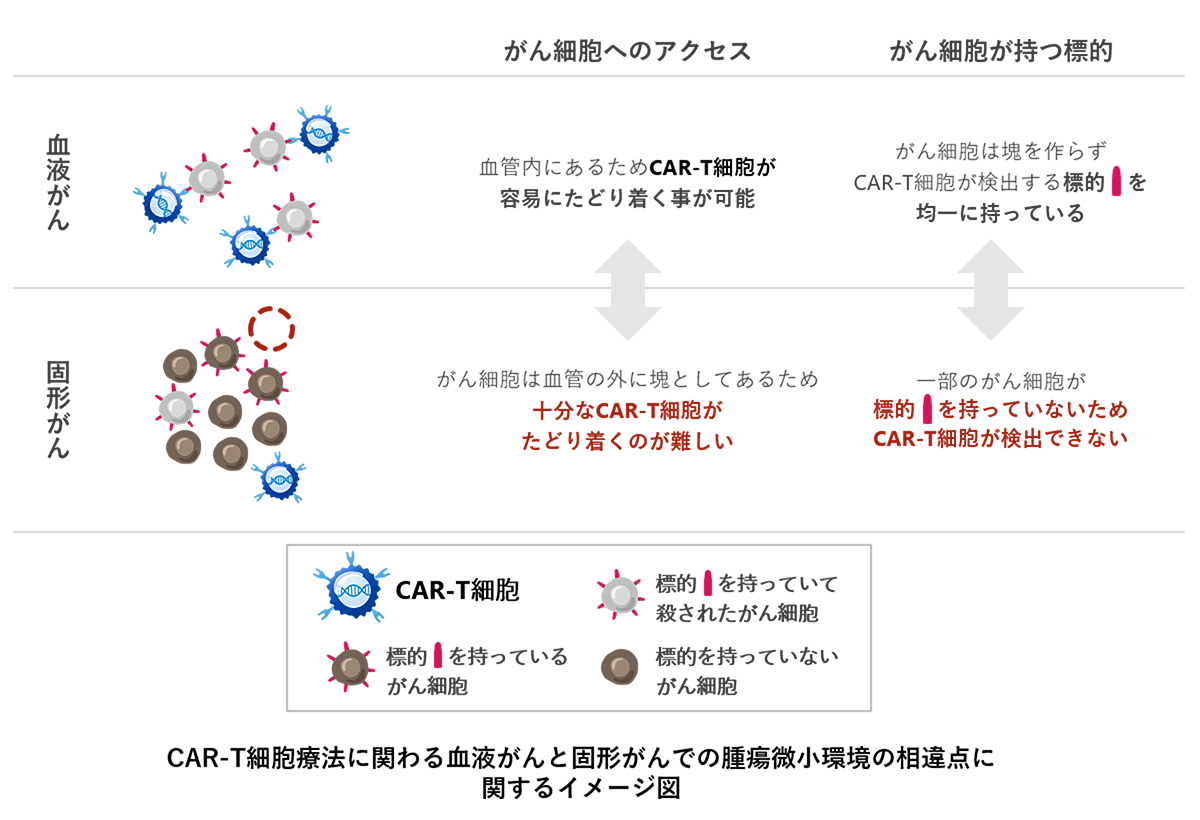
しかし、その一方で血液がん以外の固形がんに関しては、未だ優れた治療効果を示すことができていません。実際、固形がんを標的としたCAR-T細胞療法は各国の研究機関や製薬企業で開発が進められていますが、これまでに承認されたものはありません。固形がんでの開発が難しい理由として、下記イメージのように血液がんの場合と異なる点が知られており、固形がん局所へのCAR-T細胞の送達性及び固形がんの不均一性 (tumor heterogeneity)が課題とされています。
ノイルイミューン・バイオテックの取り組み
PRIME CAR-T細胞療法
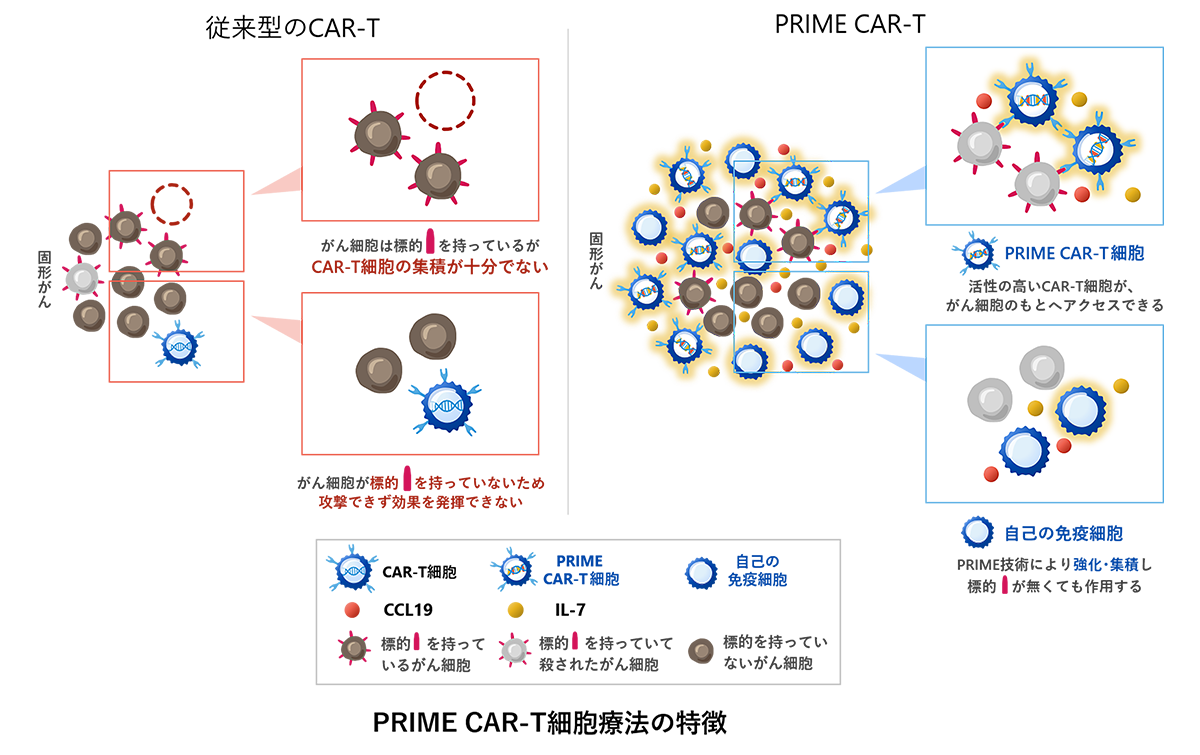
従来のCAR-T細胞療法では、十分なCAR-T細胞を固形がんの組織まで届けることは困難と考えられます。またCAR-T細胞は特定のがん抗原を発現したがん細胞を選択的に攻撃することはできますが、がん抗原を発現していないがん細胞を攻撃することはできません。
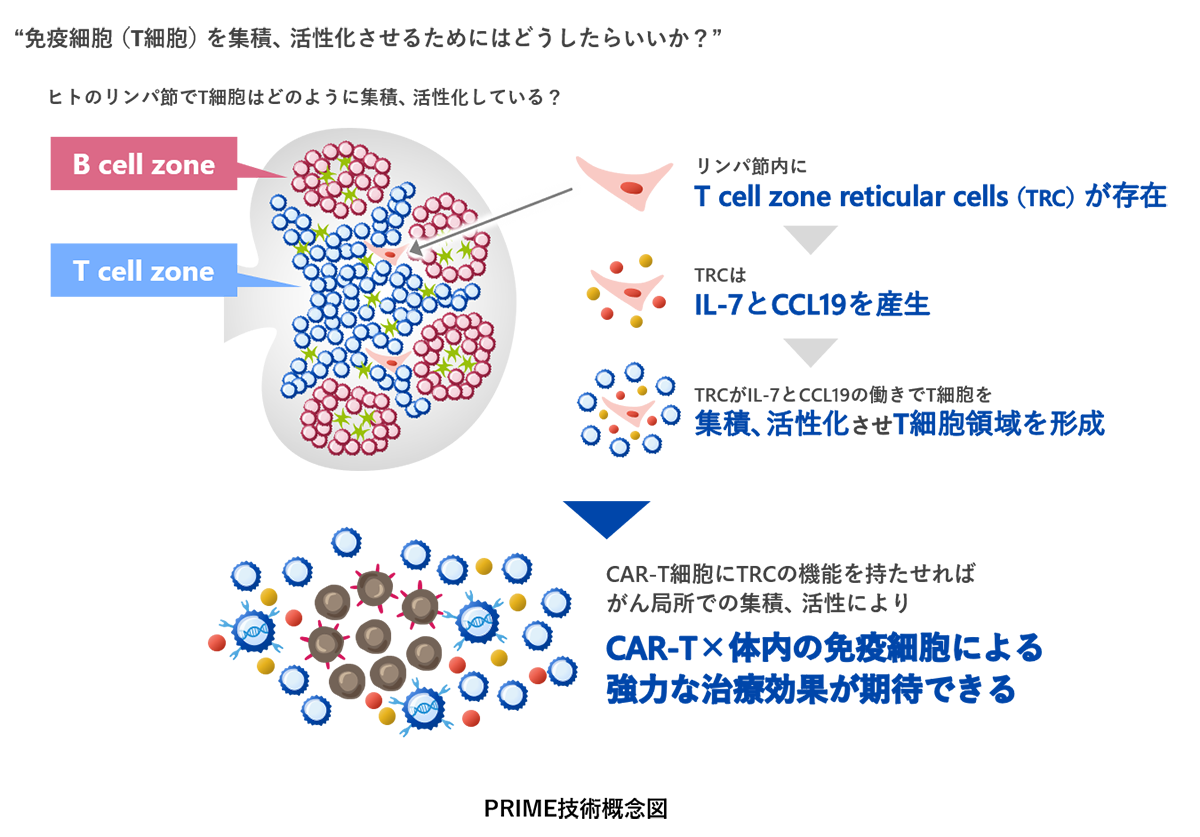
PRIME CAR-T細胞療法ではCAR-T細胞がインターロイキン-7 (IL-7)とCCL19を産生するように改良しています。IL-7とCCL19は、体内のリンパ節においてT細胞や樹状細胞が豊富に集積しているT細胞領域と呼ばれる部分に存在する細網線維芽細胞(fibroblastic reticular cell)が産生する免疫調整物質であり、T細胞領域の形成に重要な寄与をしていると考えられています。またそれぞれの機能として、IL-7はT細胞の増殖や生存維持を促進すること、CCL19はT細胞や樹状細胞の遊走能を向上させることが知られています。PRIME技術は上記のように体内のリンパ節において形成されるT細胞領域に類似した構造をがん局所において形成させることにより、CAR-T細胞と体内の免疫細胞ががん細胞を攻撃しやすい環境を作ることを目的として開発しました。
動物モデルでの検討では、PRIME CAR-T細胞は固形がんを有するマウスに対して静脈注射での投与にて従来のCAR-T細胞よりも顕著にがん組織に集積し、極めて高いがん治療効果を発揮することが報告されています。(Nature Biotechnology, 36(4):346-351, 2018)。
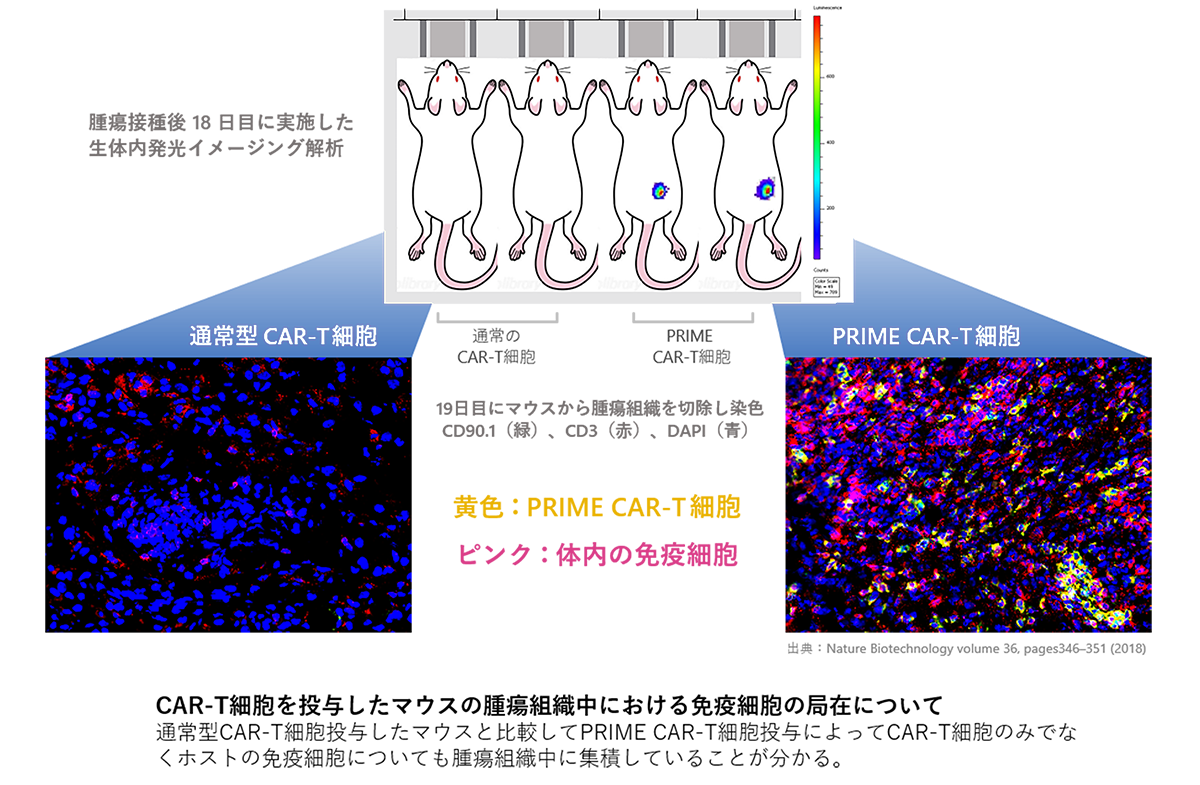
また、PRIME CAR-T細胞による治療により固形がんがいったん消滅したマウスにおいては、CARの標的抗原を有するがん細胞のみならず、標的抗原を欠損した親株のがん細胞に対しても長期間の再発予防効果を有することが示されています(同論文)。
PRIME技術に関連する文献一覧
- Nature Biotechnology,36(4):346-351, 2018
- Cancer Immunol Immunother 70, 2503-2515, 2021
- Mol Cancer Ther. 21(1):138-148, 2022
